Delo raziskovalne skupine za biokemijo je usmerjeno v raziskave zgradbe in funkcije beljakovin ali drugih snovi, ki se vežejo z biološkimi ter umetnimi lipidnimi membranami oz. nekaterimi receptorji v membranah, jih preoblikujejo in v njih tvorijo transmembranske pore. V zvezi s temi procesi preučujemo potencialno uporabo teh beljakovin (ali drugih snovi) v biomedicini, farmaciji in drugje. Tehnike, ki jih uporabljamo, spadajo v niz biokemijskih preparativnih in analitskih metod in molekularno-bioloških metod. Pripravljamo in preučujemo lastnosti modelnih lipidnih sistemov kot so umetni lipidni vezikli različnih velikosti (SUV, LUV, GUV), lipidne kapljice in Langmuirovi lipidni monosloji. S pomočjo površinske plazmonske resonance in Langmuirjeve tehtnice preučujemo kinetiko in interakcije proteinov z lipidnimi membranami in drugimi ligandi (proteini, nukleinskimi kislinami, manjšimi ligandi). Rutinsko merimo aktivnost različnih encimov (predvsem holinesteraz in encimov oksidativnega stresa) v bioloških vzorcih ter izvajamo analize kinetike encimske aktivnosti. V okviru katedre deluje Zunanja povezava na Infrastrukturni center za raziskave molekulskih interakcij Odpira se v novem oknu.

Zaposleni
- Zunanja povezava na Kristina Sepčić Odpira se v novem oknu, predstojnica katedre
- Zunanja povezava na Matej Butala Odpira se v novem oknu
- Zunanja povezava na Gregor Bajc Odpira se v novem oknu
- Zunanja povezava na Maja Hostnik Odpira se v novem oknu
- Zunanja povezava na Luka Žeželj Odpira se v novem oknu
- Tadeja Bele
- Simona Gričar
- Ana Ogrin
- Samo Grgurevič
- Anastasija Panevska
- Zunanja povezava na Bojana Starčević Ilić Odpira se v novem oknu
PEDAGOŠKA DEJAVNOST
Študijski programi 1. in 2. stopnje:
- Biologija: Biokemija, Toksinologija, Bioinformatika, Genomika in proteomika, Molekulska biologija membran, Molekulska biologija genov
- Mikrobiologija: Biokemija, Mikrobna biokemija, Mikrob in patogeneza
- Biotehnologija: Biokemija, Osnove bioinformatike, Bakteriofagi
- Biologija-kemija in Biologija-gospodinjstvo (Pedagoška fakulteta): Biokemija
Podiplomski študijski program
- Bioznanosti: Molekulska in sistemska biologija, Toksini in biomembrane, Analize interakcij med molekulami s površinsko plazmonsko resonanco, Naravna zdravila iz gliv, rastlin in živali
- Interdisciplinarni doktorski študijski program Biomedicina: Izbrana poglavja iz biokemije in molekularne biologije
OPREMA
Laboratorij ima opremo za raziskovanje na področjih biokemije, molekularne biologije in mikrobiologije:
- nizkotlačna tekočinska kromatografija,
- FPLC,
- enote za elektroforezo in izoelektrično fokusiranje,
- naprava za PCR,
- UV-VIS spektrofotometer,
- spektrofluorimeter,
- VIS in fluorescenčna čitalca za mikrotitrske mikroplošče
- Langmuirjeva tehtnica,
- sonikator,
- rotavapor,
- vakuumski koncentrator,
- stresalniki,
- centrifuge
- hladna komora.
V okviru katedre deluje tudi Infrastrukturni center za raziskave molekulskih interakcij, ki premore:
- dva refraktometra za merjenje površinske plazmonske resonance (Biacore X in Biacore T100 nadgrajen na nivo aparata T200)
- spektrometer s hitrim mešanjem raztopin (Stopped Flow SX-20).
RAZISKOVALNO DELO
- Biološka vloga in aplikacije proteinov iz družine egerolizinov
- Biologija bakteriofaga GIL01
- Vpliv bakteriofaga na razvoj in larvicidno aktivnost bakterije Bacillus thuringiensis s parazitizmu podobno modulacijo
- Zunanja povezava na Infrastrukturni center za raziskave molekulskih interakcij Odpira se v novem oknu
Pogodbeni raziskovalni projekti:
- Zunanja povezava na J4-50147 - Raziskave teranostičnega potenciala egerolizinskih proteinov v boju proti raku sečnega mehurja Odpira se v novem oknu01.10.2023 – 30.09.2026 Kristina Sepčić
- Zunanja povezava na J1-4394 Vpliv bakteriofaga na razvoj in larvicidno aktivnost bakterije Bacillus thuringiensis s parazitizmu podobno modulacijo Odpira se v novem oknu01.10.2022 - 30.09.2025 Butala Matej
Pogodbeni raziskovalni program:
- Zunanja povezava na P1-0207 Toksini in biomembrane Odpira se v novem oknu (vodja: prof. dr. Igor Križaj, financira ARRS)
Biološka vloga in aplikacije proteinov iz družine egerolizinov
Egerolizini so okoli 15 kDa veliki proteini, ki interagirajo s specifičnimi membranskimi lipidi, in jih večinoma proizvajajo bakterije in glive. Izbrani egerolizini iz gliv rodu Pleurotus se vežejo na za organizem specifične membranske sfingolipide in jih lahko uporabljamo kot univerzalne označevalce teh lipidov v živih celicah in umetnih lipidnih sistemih. V prisotnosti proteinskega partnerja, ki ima domeno kompleksa, ki napade membrano/perforin (MACPF), tvorijo egerolizini transmembranske pore v tarčnih membranah, in povzročijo takojšnjo celično smrt. Citolitični kompleksi egerolizinov in njihovih MACPF-proteinskih partnerjev so tako lahko uporabni za selektivno uničevanje celic, ki v svojih membranah vsebujejo egerolizinsko lipidno tarčno. V skupini proučujemo citolitične komplekse na osnovi egerolizinov, ki so selektivno toksični za izbrane rastlinske škodljivce iz skupine hroščev, ter komplekse, ki so selektivno toksični za celice raka urotelija (Slika).
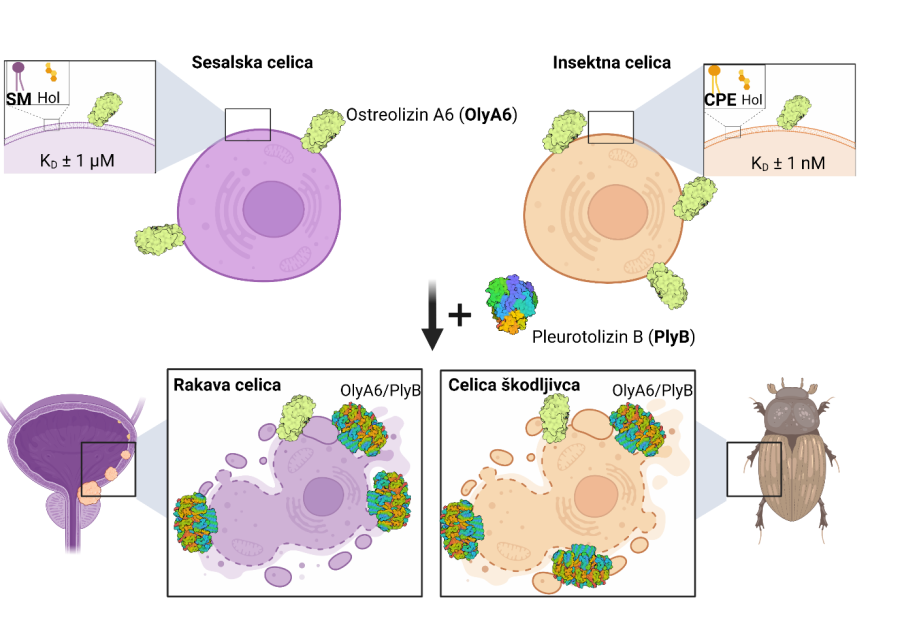
Možnosti uporabe citolitičnih kompleksov na osnovi egerolizinskega proteina OlyA6. Levo: Sesalske celice. OlyA6 prepozna specifično konformacijo sfingomielina (SM), ki je v interakciji s holesterolom. Prisotnost MACPF-proteinskega partnerja pleurotolizina B (PlyB) povzroči tvorbo por v celičnih membranah, ki povzročijo smrt tarčnih celic. Urotelijske rakave celice so obogatene s SM/holesterol domenami in predstavljajo potencialno tarčo za uničevanje s kompleksom OlyA6/PlyB [Resnik in sod., 2015; PLoS ONE 10(9): e0137878]. Desno: Insektne celice. OlyA6 se s 1000-krat večjo afiniteto veže na sfingolipid ceramid fosfoetanolamin (CPE), ki je specifičen za membrano nevretenčarjev, kot pa na SM. Kombinacijo OlyA6 in PlyB lahko uporabljamo kot nov bioinsekticid, saj le-ta uniči celice škodljivca [Panevska in sod., 2019; Sci Rep 25;9(1):5073].
Več na Zunanja povezava na povezavi Odpira se v novem oknu.
Virusi bakterij (bakteriofagi) pomembno vplivajo na ekologijo in evolucijo bakterij. Bakteriofagi so razvili raznolike in prefinjene molekularne mehanizme s katerimi si prilagodijo procese v bakteriji, da te sintetizirajo nove viruse, ki se sprostijo ob lizi gostiteljske bakterije. Pojasnili smo dosedaj še neopisano genetsko stikalo, s katerim bakteriofag GIL01 entomopatogene bakterije Bacillus thuringiensis preklopi iz spečega, dormantnega cikla v sprožitev sinteze novih virusov. Dokazali smo, da proces uravnavajo trije majhni proteini bakteriofaga. Nadalje, preučujemo morebiten vpliv bakteriofaga GIL01 na preživelost larv komarja Aedes albopictus ob izpostavitvi formulacijam bakterije B. thuringiensis.
Več na povezavi:
Sintetizer DNA
Protein AbiK bakterije Lactococcus lactis uvrščamo v družino reverznih transkriptaz, ki omogočajo bakteriji obrambo pred bakteriofagi. Polimeraza AbiK sintetizira eno verižno DNA v odsotnosti matrične DNA. V skupini raziskujemo lastnosti encima AbiK, da bi razvili način za učinkovito sintezo DNA z izbranim nukleotidnim zaporedjem. Za namen hrambe digitalnih podatkov v DNA, smo razvili metodo, s katero zapišemo informacijo v molekulo DNA.
Več na Zunanja povezava na povezavi. Odpira se v novem oknu
ARHIV RAZISKOVALNEGA DELA
- Zunanja povezava na Aktinoporini in α-porotvorni toksini Odpira se v novem oknu
- Zunanja povezava na Nanoemulzije in umetne lipidne kapljice Odpira se v novem oknu
- Zunanja povezava na Raziskave farmakološko aktivnih naravnih produktov iz morskih organizmov Odpira se v novem oknu
- Zunanja povezava na Izdelava metode za prepoznavo na DNA neposredno ali posredno vezanih proteinov v bakteriji Odpira se v novem oknu
Veliko sodelujemo tudi pri raziskavih zunanjih organizacij. Takšne objave si lahko ogledate na Zunanja povezava na povezavi Odpira se v novem oknu.
NAJODMEVNEJŠE NOVICE NA NAŠI KATEDRI
- November, 2024: Gregor Bajc je dobitnik Priznanja za strokovne delavce Univerze v Ljubljani za izjemne dosežke pri strokovnem, pedagoškem in znanstveno-raziskovalnem delu.
- November, 2024: Predlog Oddelka za biologijo »Pogačar K, Grundner M, Žigon P, Coll Rius A, Panevska A, Lukan T, Petek M, Razinger J, Gruden K, Sepčić K. Protein complexes from edible mushrooms as a sustainable potato protection against coleopteran pests. Plant biotechnology journal« je bil uvrščen med Najodličnejše dosežke na UL v letu 2024.
- September, 2024: Dr. Anastasija Panevska je prejemnica Lapanjetovega priznanja, ki ga podeljuje Slovensko Biokemijsko Društvo.
- December, 2022 - Jan Otoničar je prejemnik Prešernove nagrade za študentke in študente Univerze v Ljubljani (mentor izr. prof. dr. Matej Butala). Več naZunanja povezava na povezavi Odpira se v novem oknu.
- December, 2022 - Anže Lovše je prejemnik Prešernove nagrade Biotehniške fakultete (mentor izr. prof. dr. Matej Butala, somentor dr. Janez Kokošar).
- Oktober, 2022 - izr. prof. dr. Matej Butala je skupaj s kolegi iz Inštituta za vode RS, Fakultete za kemijo in kemijsko tehnologijo, podjetja Omega d. o. o., Kemijskega inštituta in Instituta Jožef Stefan objavil študijo o mikroplastiki v jedru zrna toče. Več na Zunanja povezava na povezavi Odpira se v novem oknu (objavljeno tudi na Zunanja povezava na RTV Odpira se v novem oknu, Zunanja povezava na 24ur Odpira se v novem oknu).
- December, 2021 - Dr. Anastasija Panevska je prejemnica Svečane listine za mlade visokošolske učiteljice in učitelje ter visokošolske sodelavke in sodelavce, ki jo podeljuje Univerza v Ljubljani. Več na Zunanja povezava na povezavi Odpira se v novem oknu.
- December, 2021 - Matej Milijaš Jotić je prejemnik Prešernove nagrade za študentke in študente Univerze v Ljubljani (mentorica prof. dr. Kristina Sepčić, somentor prof. dr. Rok Kostanjšek). Več na Zunanja povezava na povezavi Odpira se v novem oknu.
- November 2020 - Rektorjeva nagrada za naj inovacijo Univerze v Ljubljani, inovacija z naslovom ''Učinkovita strategija za zatiranje dveh svetovno pomembnih rastlinskih škodljivcev – koloradskega in koruznega hrošča''. Več na Zunanja povezava na povezavi Odpira se v novem oknu.
- September 2020 - Prof. Kristina Sepčić je prejela Lapanjetovo nagrado Slovenskega biokemijskega društva (SBD). Lapanjetova nagrada je strokovno priznanje, ki se podeli članu SBD za vrhunske dosežke na področju biokemijskih znanosti na znanstveno-raziskovalnem ali pedagoške področju, s katerim je pomembno prispeval k razvoju biokemijskih znanosti v slovenskem in mednarodnem prostoru. To priznanje se podeli tudi za uspešen prenos znanstveno-raziskovalnh izsledkov v prakso. Več na Zunanja povezava na povezavi Odpira se v novem oknu.
- September 2020 - Prof. Kristina Sepčić je dobila tudi priznanje Mentor leta društva Mlada akademija. Priznanje je namenjeno promociji dobrega mentorstva in dobrih mentorskih praks, pa tudi osebnemu priznanju posameznih dobrih mentorjev. Več na Zunanja povezava na povezavi Odpira se v novem oknu. Postala je tudi Zunanja povezava na Ime tedna na radiu Val 202 Odpira se v novem oknu.
