Področje raziskovanja in pomen novega tehnološkega pristopa
Problematika, s katero se ukvarja skupina na Biotehniški fakulteti se nanaša na iskanje oz. razvoj novih protimikrobnih učinkovin zaradi vse večje pojavnosti bakterij odpornih proti antibiotikom, ki predstavlja veliko grožnjo javnemu zdravstvu. Po podatkih WHO je v letu 2019 odpornost na antibiotike po svetu že zahtevala okoli 5 milijonov žrtev [Zunanja povezava na 1 Odpira se v novem oknu] . Po ocenah različnih inštitucij bi infekcije do leta 2050 lahko povzročile 10 milijonov smrti na leto. Tako bi se število smrtnih primerov zaradi infekcij izanačilo z številom smrtnih primerov zaradi rakastih obolenj [Zunanja povezava na 2 Odpira se v novem oknu]. Potreba po novih antibiotikih je torej izjemnega pomena. Zanimivo je, da večina antibiotikov danes še vedno izhaja iz naravnih učinkovin, in prav aktinobakterije so se pokazale kot najbolj bogatih virov teh učinkovin. Stagnacija odkritij novih antibiotikov v zadnjih desetletjih daje občutek, da smo te vire že dodobra izčrpali. Vendar, s prihodom novih metod sekvenciranja genomov bakterij, in zahvaljujoč razvoju visoko zmogljivih bioinformatskih orodji (sedaj tudi umetne inteligence), obstajajo pozitivne napovedi, da smo izolirali in ovrednotili aktivnost le okoli 3% učinkovin [Zunanja povezava na 3 Odpira se v novem oknu], ki jih bakterije lahko proizvajajo. Torej obstajajo številne biosintezne poti, ki jih kodirajo geni za biosintezo učinkovin, ki jih še ne poznamo, t.i. »tihe« gruče biosinteznih genov. Gruče biosinteznih genov (GBG) so skupine genov lociranih na enem mestu v kromosomu bakterije, ki kodirajo biosintezo neke učinkovine. Presenetljivo, so številni projekti sekvenciranja genomov bakterij pokazale, da lahko ena sama bakterija vsebuje veliko število GBG. Tako ima lahko ena aktinomiceta 20-60 genskih gruč, čeprav v laboratorijskeh pogojih pogosto zaznamo samo biosintezo ene, ali pa v najboljšem primeru nekaj učinkovin. Bakterije so torej še vedno bogat vir teh metabolitov, le da jih v laboratorijskem okolju ne znamo »aktivirati«, zato jih danes imenujemo »tihe« genske gruče. Tako npr. za modelno aktinomiceto Streptomyces rimosus (Slika 1), ki proizvaja pomemben antibiotik oksitetraciklin je bilo dolgo poznano, da proizvaja ta aktinomiceta le dva antibiotika - oksitetraciklin in protiglivni antibiotik rimocidin. Vendar smo v zadnjem desetletju z delom na BF, in ob raziskavah drugih raziskovalnih skupin po svetu danes uspeli detektirati, ali pa s pomočjo bioinformatskih orodji določiti 16 učinkovin, ki jih ta aktinobakterija lahko sintetizira. Kar je še vedno relativno malo, če upoštevamo, da v njen genom kodira 49 GBG (Slika 2). V aktinomicetah torej še vedno obstaja izjemen biotehnološki potencial, na čemer delajo najbolj napredne raziskovalne inštitucije in nova biotehnološka podjetja.
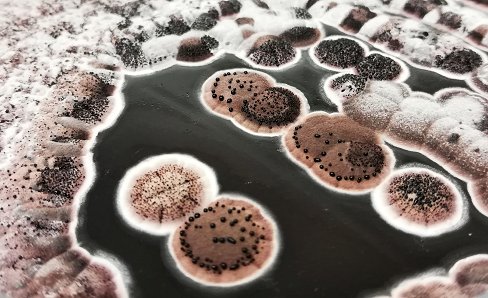
Slika 1 – Gensko manipuliran sev bakterije Streptomyces rimosus, ki proizvaja antibiotik oksitetraciklin.
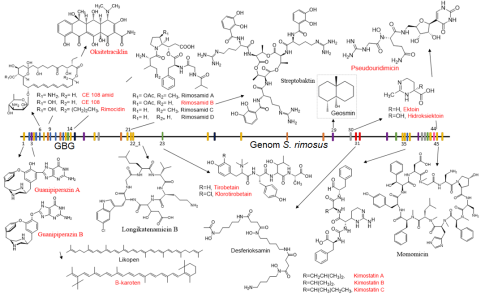
Slika 2 – Metaboliti, ki so bili identificirani ali pa določeni s pomočjo bioinformatskih orodji v v aktinomiceti Streptomyces rimosus proizvaja [Zunanja povezava na 5 Odpira se v novem oknu]. GBG – gruče biosinteznih genov (barvne oznake)
Novo tehnologijo , ki smo jo razvili predstavlja obetaven tehnološki pristop za obujanje tihih genskih gruč za biosintezo novih antibiotikov
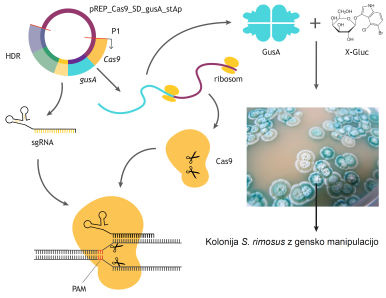
V obsegu dela mladih raziskovalcev dr. Lucije Slemc in Alena Pšeničnika, smo se osredotočili na razvoj novih antibiotikov s postopki sintezne biologije, ob enem pa »naleteli« na nov tehnološki pristop, ki bi lahko obudil tihe genske gruče, kar je tudi vsebina vložene patentne aplikacije. V prvem pomembnem koraku, je Alen Pšeničnik razvil novo verzijo naprednega molekularnega orodja CRISPR-Cas9, v katerem je ta sistem za inženiring DNA združil s poročevalskim sistemom, ki nam sedaj omogoča hitro in relativno enostavno gensko manipulacijo aktinomicet (Slika 4) [Zunanja povezava na 3 Odpira se v novem oknu].
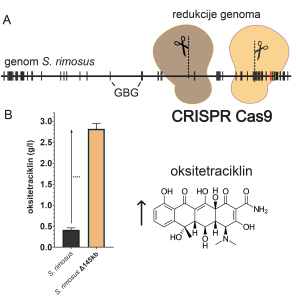
S pomočjo te metode lahko zelo hitro vnašamo spremebe v genom S. rimosus. Prav z originalnim in hitrim pristopom »redukcije genoma«, ki smo ga razvili, lahko sedaj zelo hitro vnašamo velike delecije na specifična mesta v kromosomu aktinobakterij (Slika 3A). V modelnem sistemu se je pokazalo, da lahko takšne modifikacije aktivirajo ciljno GBG, v našem primeru gensko gručo, ki kodira antibiotik oksitetraciklin, s čimer se izražanje teh genov izjemno poveča, kar se odraža v visokih titrih (količinah) antibiotika, ki ga ta gensko manipuliran sev producira (Slika 3B). Ob tem smo v manipuliranem sevu aktivirali tudi nekatere genske gruče, ki so bile prej popolnoma tihe, in se njihovi geni se niso izražali. Prav ta nov način »redukcije genoma« nam omogoča aktivacijo tihih genskih skupin v modelnem sevu S. rimosus.
Slika 3 – A genom bakterije Streptomyces rimosus in shematski prikaz redukcije genoma s orodjem CRISPR-Cas9, C dvig donosa antibiotika oksitetraciklina z izvedeno 145kb redukcijo genoma.
Tehnologijo, ki je v postopku intelektualne zaščite, pa je načeloma mogoče uporabiti na vseh mikroorganizmih. Znanstvena publikacija, ki je v pripravi, in delno pokriva to novo odkritje je dostopna na odprtem poratalu »The Research Square« [Zunanja povezava na 4 Odpira se v novem oknu]. Verjamemo, da bo nov metodološki pristop v bodočnosti omogočil identifikacijo novih antibiotikov. Seveda pa je potreben nadaljen razvoj nove tehnologije, izvesti nova testiranja in razširitev njene uporabnosti oz. robustnosti na drugih mikroorganizmih, za kar bomo potrebovali nova sredstva. Sredstva Inovacijskega sklada Univerze v Ljubljani nam omogočajo, da lažje razvijamo in potencialno komercializiramo novo tehnologijo.
Slika 4 – Sistem optimizacije CRISPR-Cas9 orodja v S. rimosus z uporabo reporterskega proteina GusA [Zunanja povezava na 3 Odpira se v novem oknu] Vidne so bele in modre kolonije aktinobakterije S. rimosus. Modro obarvanje kolonije je rezultat delovanja reporterskega encima. Pravilna modifikacija genoma v našem reporterskem sistemu zgodi v modrih kolonijah, kar nam bistveno olajša delo pri selekciji gensko manipuliranih sevov. Bele kolonije S. rimosus ne vsebujejo genske modifikacije.